| 전문가 자문 |
- 기기 개발 전 또는 개발 중에 전문가(의사, 간호사, 보건직, 의공학자, 통계 등)를 통해 의료기기 개발에 대한 의견을 취합
- 제조업체의 질문사항을 해당기기에 대한 임상 경험을 갖춘 전문가에게 직접 자유롭게 질의 가능
|
| 벤치마크 |
- 타 제품과 개발된 제품을 비교하여 장단점을 파악
- 개발 제품이 없는 경우에도 비슷한 제품 간의 비교로 장단점을 취합
|
| 포커스그룹 인터뷰 |
- 전문가(의사, 간호사, 보건직, 의공학자, 통계 등) 또는 사용자를 소그룹(5~10명)으로 구성하여 정해진 질문 내에서 토론
|
| 휴리스틱 분석 |
- 사용적합성 전문가를 통해 해당기기의 잠재적으로 발생 가능한 문제들을 발굴
- 사용성에 관한 지표(단순성, 접근성, 효율성, 학습성 등)를 설정하고, 각 지표의 수준에 미달하는 것들을 문제로 지적, 실질적인 대안을 제시
- 사용적합성 전문가: 사용성 평가의 경험이 많고 사용 적합성의 이해도가 높은 자 (실제 사용자 포함)
|
| 임상환경 관찰 |
- 실제 임상환경 (ex: 병실, 수술실 등)에서 유사 의료기기의 사용을 관찰
|
| 사용적합성시험 |
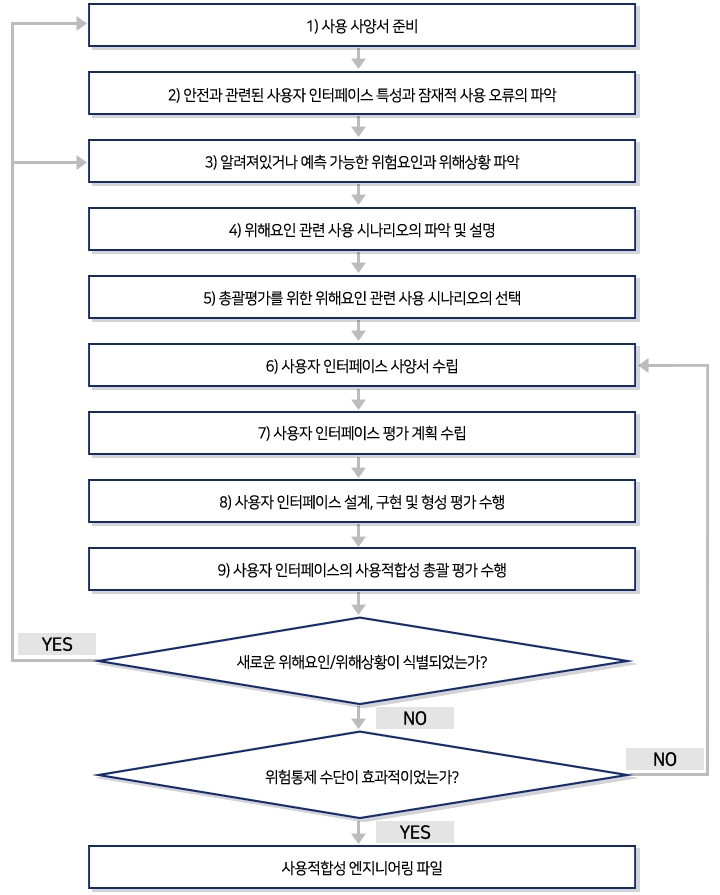
형성평가 |
- 의료기기의 사용 오류를 찾아내는 활동으로 주로 의료기기 개발 초기 과정에서 사용자 인터페이스 설계와 함께 진행
|
| 총괄평가 |
- 사용자 인터페이스의 안전을 확증하기 위해 사용되는 최종 점검 단계이며, 주로 의료기기 개발 단계에서 설계 밸리데이션 활동의 일부로서 수행
|